Cell:中山大学团队揭示线粒体定位的环状RNA(circRNA)调控肝脏免疫代谢性炎症新机制
2020-11-04 | Affinity
2020年9月14日,中山大学苏士成团队在国际顶尖学术期刊《Cell》 在线发表题为 “Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output”的论文,文章揭示线粒体环状RNA在非酒精性脂肪性肝炎(NASH)中调控肝脏免疫代谢性炎症新机制。研究确定了一种线粒体特异性circRNA(SCAR),在NASH中表达下调,当向线粒体特异性递送SCAR,可降低线粒体活性氧(mROS)输出和成纤维细胞活化,减轻炎症反应,可作为NASH的治疗靶标。
NASH患者的肝星状细胞在高脂负荷下会发生内质网应激,内质网应激导致CHOP的上调,CHOP上调会抑制PGC-1α的表达,进而抑制了circRNA(SCAR)的表达,circRNA(SCAR)的下调解除了对CypD-mPTP结合的抑制,促进mPTP开放从而增加了mROS的输出,最终导致星状细胞的过度激活和肝代谢性炎症的加重。
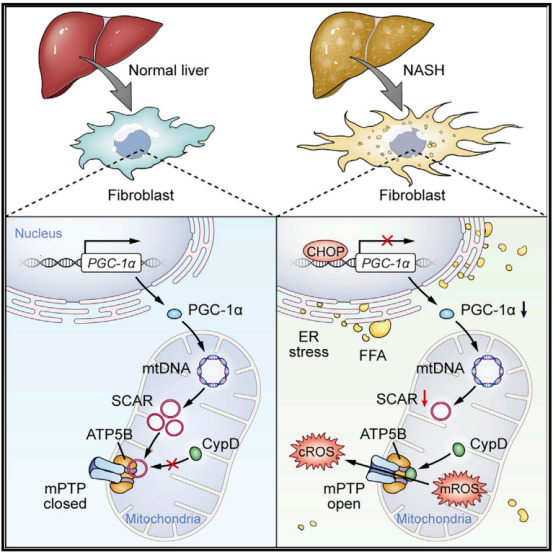
(研究机制图)
研究团队通过构建靶向线粒体RNA的纳米递送系统,可以向线粒体特异性递送SCAR,借助该靶向系统,作者发现干预其中一条线粒体circRNA(SCAR)可以显著抑制mROS的生成和输出、成纤维细胞的激活、炎症因子的产生等代谢炎症表型。
该研究阐明了高脂压力导致的内质网-细胞核-线粒体跨细胞器信号轴失衡导致免疫代谢性疾病进展的新机制,团队率先构建了靶向线粒体环状RNA的纳米递送系统,实现在体内外干预线粒体环状RNA,可以为靶向线粒体信号治疗代谢性免疫疾病提供新思路。
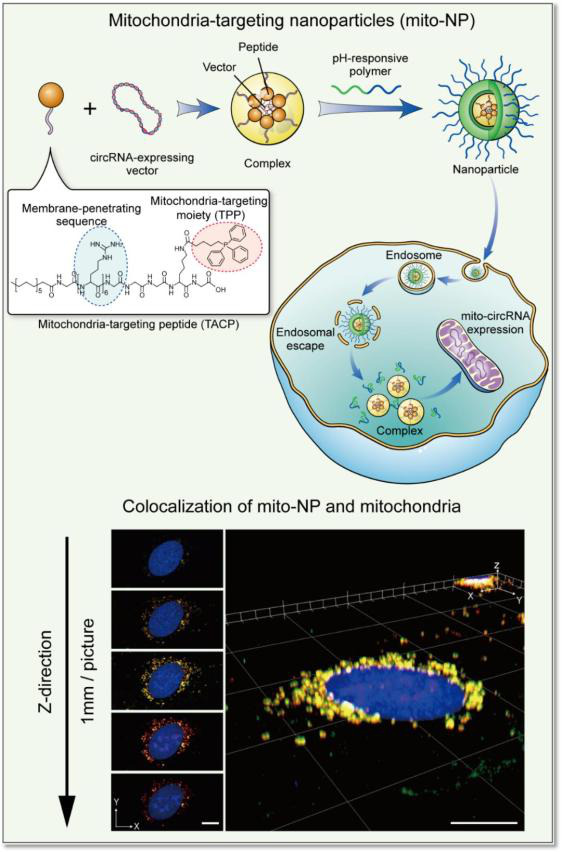
(靶向线粒体circRNA的纳米递送系统)
该研究中涉及内质网应激的PERK通路,即应激发生导致PERK磷酸化并形成二聚体,P-PERK磷酸化下游eIF2,P-eIF2可以促进转录因子ATF4的上调,ATF4又会启动CHOP的转录。其中用到的Phospho-PERK (Thr982) Antibody(Cat# DF7576; RRID: AB_2833024)来自于Affinity Biosciences。
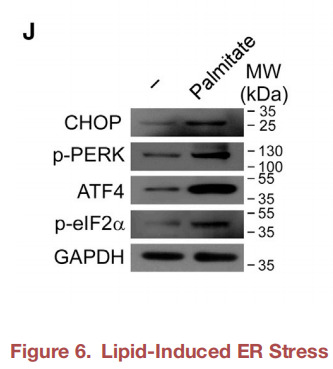
((J) Representative western blots for CHOP, p-PERK, ATF4, and p-eIF2a in normal fibroblasts treated with palmitate (n = 3 patients).)
Affinty拥有内质网应激通路相关众多的关键蛋白抗体,全部现货销售,有需要的小伙伴欢迎咨询下单,当天发货,全国空运。
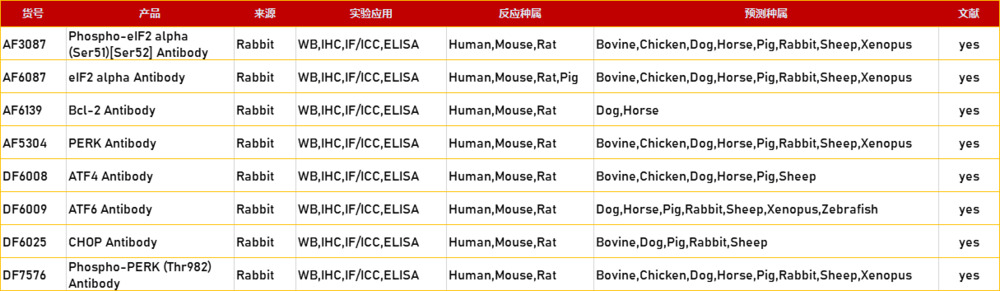
产品列表: